Tipps und mehr. (Dialyse)

Haftungsausschluss / Medizinischer Hinweis
Die auf dieser Webseite bereitgestellten Inhalte dienen ausschließlich zu allgemeinen Informationszwecken. Sie wurden mit größter Sorgfalt recherchiert und nach bestem Wissen erstellt. Dennoch ersetzen sie keinesfalls eine individuelle medizinische Beratung, Diagnose oder Behandlung durch approbierte Ärztinnen und Ärzte oder andere medizinische Fachpersonen.
Bitte wenden Sie sich bei gesundheitlichen Beschwerden oder Fragen immer an Ihre behandelnde Ärztin, Ihren Arzt oder eine andere qualifizierte medizinische Fachkraft. Beginnen, verändern oder beenden Sie niemals eine Behandlung eigenständig aufgrund der Informationen, die Sie auf dieser Webseite gefunden haben.
Die Betreiber dieser Seite übernehmen keine Gewähr für die Aktualität, Vollständigkeit oder Richtigkeit der bereitgestellten Informationen. Eine Haftung für Schäden oder Konsequenzen, die direkt oder indirekt aus der Nutzung dieser Inhalte entstehen, ist, soweit gesetzlich zulässig, ausgeschlossen.
Inhalt
(einfach auf das Wort klicken)
Was ist Dialyse?
Dialyse ist ein lebenswichtiges medizinisches Verfahren, das die Aufgabe der Nieren übernimmt, wenn diese ihre Funktion nicht mehr ausreichend erfüllen können. Sie ist die häufigste Nierenersatztherapie bei Nierenversagen und sorgt dafür, dass der Körper von Abfallstoffen, eingelagerten Flüssigkeiten und überschüssigen Elektrolyten befreit wird, die sich sonst im Blut anreichern und schwerwiegende gesundheitliche Probleme verursachen würden.
Normalerweise filtern die Nieren täglich mehrere hundert Liter Blut, um Abfallprodukte des Stoffwechsels (wie Harnstoff und Kreatinin) sowie überschüssiges Wasser auszuscheiden. Wenn die Nieren diese Funktion durch eine Erkrankung, eine Verletzung oder einen fortschreitenden Funktionsverlust nicht mehr ausführen können, ist die Dialyse eine lebensrettende Alternative. Sie ersetzt jedoch nicht alle Aufgaben der Nieren, wie etwa die Produktion von Hormonen, die den Blutdruck regulieren oder die Bildung von roten Blutkörperchen anregen.
Die Dialyse kommt in zwei Hauptformen vor: der Hämodialyse, bei der das Blut durch eine Maschine außerhalb des Körpers gereinigt wird, und der Peritonealdialyse, bei der das Bauchfell als natürliche Filtermembran dient. Beide Verfahren basieren auf den Prinzipien der Diffusion und Osmose, die den Austausch von Schadstoffen, Salzen und Wasser zwischen Blut und Dialyselösung ermöglichen.
Neben ihrer technischen und medizinischen Funktion hat die Dialyse auch eine soziale und lebensqualitätsbezogene Dimension: Sie gibt Betroffenen die Möglichkeit, trotz erheblicher gesundheitlicher Einschränkungen ein möglichst selbstbestimmtes Leben zu führen. In vielen Fällen ermöglicht die Dialyse einen stabilen Gesundheitszustand, durch den die Patienten in der Lage sind eine Schule zu besuchen, einer Arbeit nachzugehen oder zu studieren. Da es ein weltweit gut ausgebautes Netz an Dialysezentren gibt, spricht auch nichts gegen Urlaubsreisen.
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die Nieren filtern täglich viel Blut und entfernen dabei überschüssige Flüssigkeit sowie Abfallprodukte des Stoffwechsels. Bei Nierenversagen sammeln sich diese schädlichen Substanzen im Körper an, was lebensbedrohlich sein kann. Die Dialyse übernimmt in solchen Fällen die lebenswichtige Reinigungsfunktion der Nieren.
Warum ist die Dialyse notwendig?
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Es gibt zwei Hauptformen der Dialyse:
Hämodialyse: Hierbei wird das Blut über einen Gefäßzugang, meist am Unterarm, aus dem Körper geleitet und durch eine Maschine – die sogenannte "künstliche Niere" – gefiltert. Der Dialysator entfernt dabei Abfallstoffe und überschüssiges Wasser. Anschließend fließt das gereinigte Blut zurück in den Körper. Eine typische Hämodialyse dauert etwa vier bis fünf Stunden und wird in der Regel dreimal pro Woche durchgeführt.
Peritonealdialyse (Bauchfelldialyse): Bei dieser Methode dient das Bauchfell (Peritoneum) als natürliche Filtermembran. Über einen Katheter wird eine spezielle Dialyselösung in die Bauchhöhle eingeführt. Abfallstoffe und überschüssiges Wasser wandern aus den Blutgefäßen des Bauchfells in die Dialyselösung, die nach einigen Stunden wieder abgelassen und durch frische Lösung ersetzt wird. Diese Form der Dialyse kann der Patient eigenständig zu Hause durchführen.
Arten der Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die Dialyse basiert auf physikalischen Prinzipien wie Diffusion und Osmose:
Diffusion: Konzentrationsunterschiede zwischen Blut und Dialyselösung ermöglichen den Austausch von Abfallstoffen und Elektrolyten über eine semipermeable Membran.
Osmose: Ein osmotischer Gradient sorgt dafür, dass überschüssiges Wasser aus dem Blut in die Dialyselösung übertritt.
Funktionsweise der Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die Dialyse wird bei akutem oder chronischem Nierenversagen eingesetzt, wenn die Nierenfunktion so weit eingeschränkt ist, dass eine ausreichende Entgiftung und Flüssigkeitsausscheidung nicht mehr gewährleistet sind. Sie kann auch bei bestimmten Vergiftungen angewendet werden, um toxische Substanzen aus dem Blut zu entfernen.
Indikationen für die Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Wie bei jedem medizinischen Eingriff können auch bei der Dialyse Komplikationen auftreten, darunter:
Blutdruckabfall: Durch den Flüssigkeitsentzug kann es zu Hypotonie kommen.
Infektionen: Insbesondere bei der Peritonealdialyse besteht ein erhöhtes Risiko für Bauchfellentzündungen (Peritonitis).
Muskelkrämpfe: Diese können durch Veränderungen im Flüssigkeits- und Elektrolythaushalt entstehen.
Risiken und Nebenwirkungen
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die Geschichte der Dialyse ist eine faszinierende Reise durch medizinische Entdeckungen und technische Innovationen, die letztendlich dazu geführt haben, dass Millionen von Menschen mit Nierenversagen ein neues Leben ermöglicht wurde. Sie zeigt, wie Pioniergeist und wissenschaftliche Neugier dazu beigetragen haben, eines der komplexesten und lebensrettendsten Verfahren der modernen Medizin zu entwickeln.
Die Anfänge: Die Idee der Trennung durch Membranen
Im Jahr 1861 beschrieb der schottische Chemiker Thomas Graham erstmals die Dialyse als ein Trennverfahren. Seine Arbeit legte den Grundstein für die Idee, schädliche Stoffe aus Flüssigkeiten zu entfernen – ein Konzept, das später auf die Medizin übertragen wurde.
Frühe Tierversuche und erste Experimente
Am 10. November 1912 führten John Jacob Abel, Leonard George Rowntree und Benjamin Turner in Baltimore eine sogenannte Vividiffusion an einem Kaninchen durch. Dies war eines der ersten dokumentierten Experimente, das die technische Möglichkeit der Dialyse zeigte. Wenige Jahre später, zwischen 1914 und 1917, führte Georg Haas erste Dialyseversuche an Hunden durch, unabhängig von Abels Arbeit, von der er erst später erfuhr.
Im Juli 1923 berichtete der Hamburger Physiologe Heinrich Necheles über Experimente an beidseitig nephrektomierten Hunden. Dabei nutzte er eine sogenannte „Sandwich-Niere“, bestehend aus Kalbsperitoneum, das in elastische Gitter eingespannt war – ein frühes Beispiel für einen innovativen Dialyseapparat.
Der Durchbruch: Erste Hämodialyse beim Menschen
Der nächste entscheidende Schritt gelang Georg Haas im Jahr 1924. Er führte die weltweit erste erfolgreiche extrakorporale Hämodialyse beim Menschen durch. Dabei nutzte er eine sogenannte Schlauchniere, die mit Kollodium als semipermeable Membran ausgestattet war, und Hirudin, ein Antikoagulans aus Blutegelspeichel. Die begrenzte Reinheit des Hirudins führte jedoch häufig zu allergischen Reaktionen, weshalb ab 1925 Heparin als Antikoagulans eingesetzt wurde. Heparin, das auch heute noch verwendet wird, ermöglichte sicherere Behandlungen, nachdem 1937 effektivere Reinigungsmethoden für diese Substanz entwickelt wurden.
Technische Innovationen und Weiterentwicklungen
Im Jahr 1937 führte Wilhelm Thalhimer Cellophan als Dialysemembran ein, was die Effizienz der Dialyse erheblich verbesserte. Nur wenige Jahre später, am 17. März 1943, nutzte der niederländische Internist Willem Kolff erstmals ein Trommeldialysegerät an einer urämischen Patientin. Diese sogenannte rotierende Trommelniere, die nach dem Prinzip der archimedischen Schraube funktionierte, setzte Zellophan-Schläuche als Membran ein und ermöglichte eine kontrollierte Blutreinigung.
1946 entwickelte Nils Alwall in Schweden ein Gerät, das nicht nur das Blut reinigte, sondern auch überschüssige Flüssigkeiten aus Lunge und Gewebe entfernte – ein wesentlicher Fortschritt für die Behandlung schwerkranker Patienten. Zwei Jahre später präsentierte der amerikanische Biochemiker Leonard Skeggs den ersten transportablen Plattendialysator, der die Dialyse flexibler und leichter handhabbar machte.
Der Weg zur Langzeitdialyse
Bis in die 1950er Jahre war die Dialyse vor allem auf die Behandlung akuter Niereninsuffizienz beschränkt. Dies lag daran, dass die notwendigen Gefäßzugänge (Vasotomien) nur eine begrenzte Anzahl von Behandlungen ermöglichten. Erst 1960 revolutionierte Belding Scribner das Verfahren, indem er den ersten arteriovenösen Shunt implantierte. Dies ermöglichte eine wiederholte und langfristige Nutzung eines Gefäßzugangs. Clyde Shields wurde der erste Patient, der chronisch mit Hämodialyse behandelt wurde. Er lebte elf Jahre mit dieser Methode, bevor er 1971 an einer kardiologischen Erkrankung verstarb.
1966 führten Brescia und Cimino einen weiteren entscheidenden Fortschritt ein: die Punktion einer zuvor angelegten arteriovenösen Anastomose einer Unterarmvene. Diese Methode, die bis heute als Standard für Langzeitdialysegefäße gilt, ermöglichte eine sicherere und effizientere Versorgung von Dialysepatienten.
Fazit
Die Entwicklung der Dialyse war ein Prozess von kleinen, aber bedeutenden Schritten, die das Verständnis der medizinischen Möglichkeiten stetig erweitert haben. Was als chemisches Experiment begann, entwickelte sich zu einem lebensrettenden Verfahren, das heute für viele Menschen mit Nierenversagen unverzichtbar ist. Die Geschichte der Dialyse ist ein eindrucksvolles Beispiel für den menschlichen Erfindungsgeist und die Bedeutung von Innovation in der Medizin.
Geschichte der Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
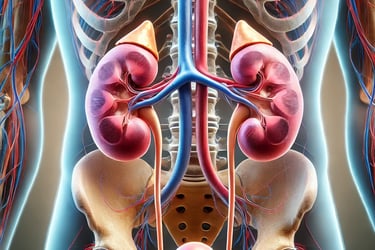
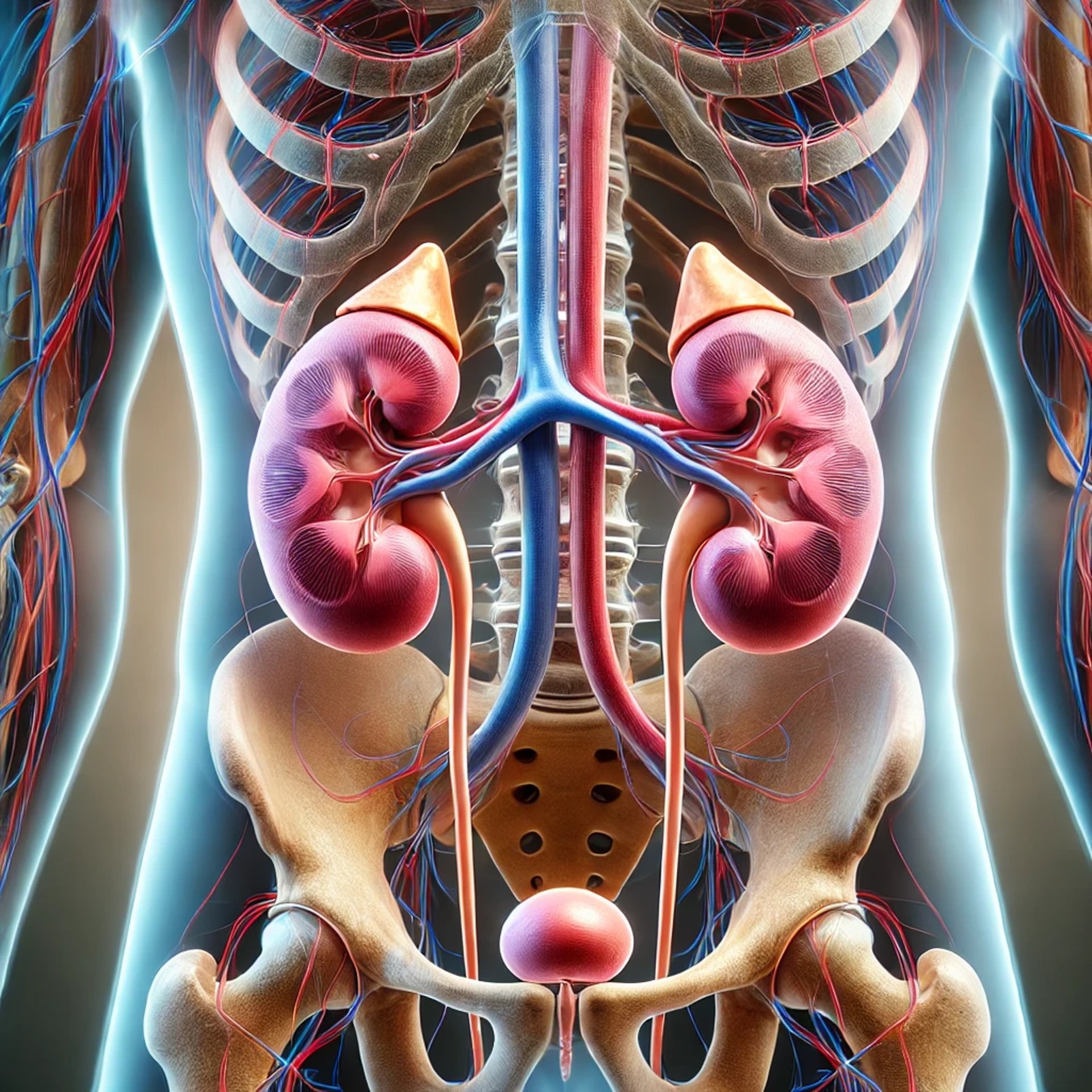
Aufbau und Lage
Die Nieren sind lebenswichtige Organe des Harnsystems und spielen eine zentrale Rolle bei der Regulierung des Flüssigkeits- und Elektrolythaushalts sowie bei der Entgiftung des Körpers. Ihre Anatomie ist speziell an ihre Funktionen angepasst.
Lage und äußeres Erscheinungsbild
Die Nieren sind paarig angelegte Organe, die sich im Retroperitonealraum befinden, also außerhalb der eigentlichen Bauchhöhle hinter dem Bauchfell (Peritoneum). Sie liegen im oberen hinteren Bauchraum beidseits der Wirbelsäule. Die rechte Niere liegt etwas tiefer als die linke, da sie von der Leber nach unten gedrückt wird.
Ihre Form ist bohnenförmig, mit einer konkaven Krümmung auf der Innenseite. Jede Niere wiegt etwa 120–200 Gramm und hat folgende Maße:
Dicke: ca. 4 cm
Breite: ca. 7 cm
Länge: ca. 11 cm
Diese Maße lassen sich leicht mit der Zahlenkombination 4711 merken.
Die Nierenpforte (Hilus)
In der konkaven Krümmung der Niere liegt die Nierenpforte, auch Hilus genannt. Hier treten wichtige Strukturen ein und aus:
Nierenarterie (Arteria renalis): Sie versorgt die Niere mit sauerstoffreichem Blut.
Nierenvene (Vena renalis): Sie leitet das gereinigte, sauerstoffarme Blut aus der Niere ab.
Nierenbecken (Pelvis renalis): Es nimmt den Harn aus der Niere auf und leitet ihn in den Harnleiter (Ureter) weiter.
Die Nierenpforte stellt somit das Verbindungszentrum der Niere mit dem restlichen Körper dar.
Innerer Aufbau der Niere
Ein Längsschnitt durch die Niere zeigt zwei deutlich unterscheidbare Schichten:
Rindenschicht (Cortex renalis):
Die äußere Schicht der Niere.
Sie ist fein gekörnt und reich an Blutgefäßen, was ihre wichtige Rolle in der Filtration des Blutes widerspiegelt.
Markschicht (Medulla renalis):
Die innere Schicht der Niere.
Sie besteht aus kegelförmigen Strukturen, den Markpyramiden, die in Richtung Hilus ausgerichtet sind.
Die Markpyramiden sind durch eine feine Längsstreifung gekennzeichnet, die auf die Anordnung der Tubuli und Sammelrohre zurückzuführen ist. Ihre Spitzen werden Nierenpapillen genannt.
Nierenpapillen und Harnleitung
Die Nierenpapillen ragen in trichterförmige Hohlräume, die als Nierenkelche bezeichnet werden. Diese spielen eine wichtige Rolle im Transport des Harns:
Die Nierenkelche sammeln den in den Nephronen gebildeten Harn.
Der Harn wird von den Nierenkelchen in das Nierenbecken (Pelvis renalis) geleitet.
Vom Nierenbecken fließt der Harn durch den Harnleiter (Ureter) weiter in die Harnblase.
Fazit
Die Nieren sind hochkomplexe Organe, die durch ihre spezielle Anatomie ideal für ihre Aufgaben ausgestattet sind. Ihre Lage im Retroperitonealraum, die effiziente Blutversorgung über Hilus und Nierenarterien sowie die innere Struktur mit Rinde, Mark und Markpyramiden ermöglichen eine präzise Filtration des Blutes und den Abtransport von Harn. Dieses Zusammenspiel macht die Niere zu einem unverzichtbaren Organ für den menschlichen Körper.
Anatomie der Niere
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
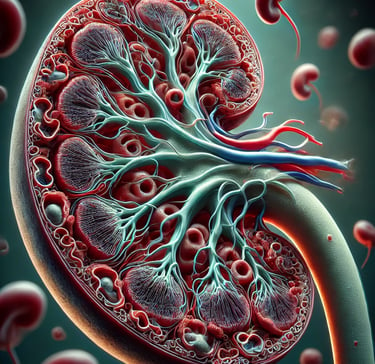
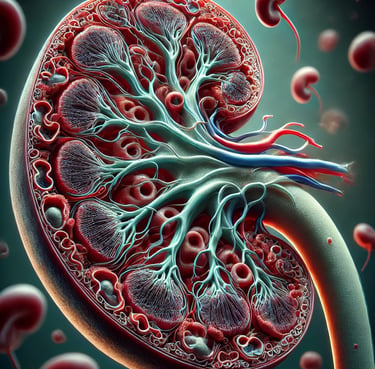
Um die Funktion der Niere besser zu verstehen, lohnt sich ein Blick auf ihren mikroskopischen Aufbau. Das Gefäßsystem spielt dabei eine zentrale Rolle, da die Niere täglich von einer enormen Menge Blut durchströmt wird – etwa 1500 Liter in 24 Stunden.
Das Gefäßsystem der Niere
Die Blutversorgung der Niere erfolgt über die Arteria renalis, die direkt von der Bauchaorta abzweigt. Jede Arteria renalis tritt über den Hilus in die Niere ein und verzweigt sich dort in ein komplexes Gefäßnetzwerk. Von diesem Hauptgefäßnetz gehen zahlreiche kleinere Abzweigungen aus, die sogenannten Vas afferents (zuführende Gefäße). Diese führen das Blut in kleine Gefäßknäuel, die als Glomeruli bezeichnet werden.
Das Nierenkörperchen: Glomerulus und Bowman-Kapsel
Die Glomeruli befinden sich in der Nierenrinde und sind von einer doppelwandigen Struktur umgeben, der Bowman-Kapsel. Zwischen der Bowman-Kapsel und dem Gefäßknäuel befindet sich ein schmaler Spalt, in dem der Primärharn durch den Blutdruck abgepresst wird.
Dieser Prozess der Filtration ist die Grundlage der Harnbildung. Der Primärharn enthält Wasser und gelöste Stoffe, aber keine Blutzellen oder größere Moleküle wie Proteine. Gemeinsam bilden Glomerulus und Bowman-Kapsel das Nierenkörperchen. In der Nierenrinde befinden sich rund eine Million Nierenkörperchen, die jeden Tag große Mengen Primärharn produzieren.
Das Tubulussystem: Vom Primärharn zum Sekundärharn
Nach der Filtration im Nierenkörperchen gelangt der Primärharn in die Nierenkanälchen, die auch als Tubuli bezeichnet werden. Der Verlauf der Tubuli ist entscheidend für die weitere Verarbeitung des Harns:
Proximaler Tubulus:
Der erste Abschnitt des Tubulussystems ist stark gewunden und liegt noch in der Nierenrinde. Hier beginnt die Rückresorption von Wasser, Elektrolyten und anderen nützlichen Stoffen.
Henle-Schleife:
Nach dem proximalen Tubulus folgt die Henle-Schleife, ein U-förmiger Abschnitt, der tief in die Markschicht der Niere eintaucht. Sie spielt eine wichtige Rolle bei der Konzentrierung des Harns.
Distaler Tubulus:
Der Tubulus wandert nach der Henle-Schleife in gewundener Form zurück in die Nierenrinde. Hier findet ein fein abgestimmter Austausch von Stoffen statt, der unter hormoneller Kontrolle steht.
Gefäßnetz um die Tubuli: Austausch von Stoffen
Die Vas efferents (abführende Gefäße) verlassen den Glomerulus und bilden ein weiteres Gefäßnetz, das die Tubuli eng umgibt. Zwischen den Tubuli und diesen Blutgefäßen findet ein intensiver Stoffaustausch statt. Dies wird als die Stoffwechselfunktion der Niere bezeichnet. Hier werden wertvolle Stoffe wie Glukose, Elektrolyte und Wasser ins Blut zurückgeführt, während Abfallstoffe in den Tubulus abgegeben werden.
Das Nephron: Die funktionelle Einheit der Niere
Ein Nephron besteht aus einem Nierenkörperchen (Glomerulus und Bowman-Kapsel) und einem Tubulussystem. Es bildet die kleinste funktionelle Einheit der Niere, von der jede Niere etwa eine Million besitzt. Die Nephrone sind für die Filtration, Rückresorption und Ausscheidung von Stoffen verantwortlich.
Vom Sammelrohr zum Harnleiter
Am Ende des Tubulussystems fließt der Harn in die Sammelrohre, die im Nierenmark liegen. Von dort wird der Harn über die Papillargänge in die Nierenkelche geleitet. Die Nierenkelche sammeln den Harn und leiten ihn in das Nierenbecken weiter.
Vom Primärharn zum Sekundärharn
Auf seinem Weg durch das Tubulussystem wird der Primärharn stark konzentriert und chemisch verändert. Während dieses Prozesses werden etwa 99% des Wassers und viele nützliche Stoffe ins Blut zurückresorbiert. Übrig bleibt der Sekundärharn, der die Abfallstoffe und überschüssigen Substanzen enthält, die der Körper ausscheiden muss.
Der Sekundärharn gelangt schließlich über den Harnleiter (Ureter) in die Harnblase, wo er bis zur Ausscheidung gespeichert wird.
Fazit
Der mikroskopische Aufbau der Niere offenbart ihre beeindruckende Effizienz. Durch ein fein abgestimmtes Zusammenspiel von Gefäßnetz, Nierenkörperchen und Tubulussystem sorgt die Niere nicht nur für die Filtration des Blutes, sondern auch für die Rückresorption lebenswichtiger Stoffe und die Ausscheidung von Abfallprodukten. Die Nieren leisten damit jeden Tag eine unverzichtbare Arbeit, die den Stoffwechsel und die Gesundheit des gesamten Körpers unterstützt.
Der Feinbau der Niere + Funktionen
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
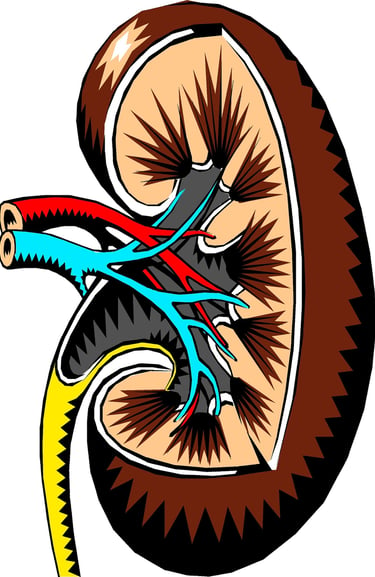
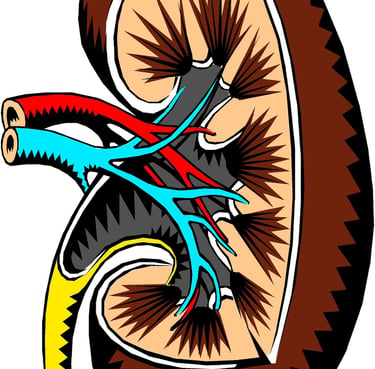
Primärharn – Die erste Stufe der Harnbildung
Die Bildung von Primärharn ist ein zentraler Prozess der Nierenfunktion, bei dem das Blut gefiltert und die Grundlage für die spätere Ausscheidung von Abfallstoffen geschaffen wird. Der Primärharn entsteht im Glomerulus, einem fein verzweigten Gefäßknäuel in der Niere, und ist das Resultat eines komplexen Zusammenspiels aus Druckverhältnissen, Filtration und Regulation.
Bildung des Primärharns
Im Glomerulus herrscht ein Blutdruck von etwa 50 mmHg, der ausreichend hoch ist, um den Primärharn aus den Blutgefäßen zu "pressen". Dieser Vorgang wird als glomeruläre Filtration bezeichnet. Pro Minute werden dabei etwa 0,12 Liter Primärharn produziert, was einem beeindruckenden Volumen von 170 Litern pro Tag entspricht. Diese enorme Menge zeigt, wie intensiv die Nieren arbeiten, um das Blut zu reinigen und den Körper im Gleichgewicht zu halten.
Der Primärharn selbst ist eine eiweißfreie, wässrige Lösung, die alle klein- und mittelmolekularen Substanzen des Blutplasmas enthält. Dazu gehören Elektrolyte, Glukose und Harnstoff, aber keine größeren Moleküle wie Proteine oder Blutzellen, da diese von der Filtrationsbarriere des Glomerulus zurückgehalten werden.
Autoregulation der Niere
Die Niere hat eine bemerkenswerte Fähigkeit, ihren Blutdruck anzupassen, um eine konstante Filtrationsrate zu gewährleisten. Dieser Mechanismus wird als Autoregulation der Niere bezeichnet und erfolgt über die glatte Muskulatur der zuführenden Gefäße (Arteriolen).
Im Alltag schwankt der Blutdruck aufgrund von Faktoren wie Stress, körperlicher Anstrengung oder Schlaf. Dank der Autoregulation bleibt die Filtration im Glomerulus jedoch weitgehend stabil. Bei einem erhöhten Blutdruck ziehen sich die Gefäße zusammen, um den Druck im Glomerulus zu senken. Bei niedrigem Blutdruck erweitern sie sich, um die Filtration aufrechtzuerhalten.
Auswirkung eines extrem niedrigen Blutdrucks
Sinkt der systemische Blutdruck unter 40 mmHg, beispielsweise infolge eines schweren Blutverlusts, versagt die Autoregulation. In solchen Fällen kommt es zur Unterbrechung der Harnbildung, da der Druck im Glomerulus nicht mehr ausreicht, um Primärharn zu produzieren. Dies kann zu Oligurie führen, bei der weniger als 500 ml Urin pro Tag ausgeschieden werden, oder zu Anurie, bei der die Urinausscheidung auf weniger als 100 ml pro Tag absinkt. Solche Zustände sind medizinische Notfälle und erfordern eine sofortige Behandlung.
Fazit
Der Primärharn ist die Grundlage für die Entgiftungsfunktion der Nieren und spiegelt die hohe Effizienz des Filtrationsprozesses wieder. Durch die Fähigkeit der Niere, den Blutdruck lokal zu regulieren, kann sie trotz alltäglicher Schwankungen des Kreislaufsystems eine gleichmäßige Harnbildung sicherstellen. In extremen Situationen, wie bei starkem Blutdruckabfall, zeigt sich jedoch, wie empfindlich dieser Prozess ist und wie lebenswichtig die Funktion der Nieren für den Körper ist.
Endharn – Der letzte Schritt der Harnbildung
Der Endharn ist das Endprodukt eines hochkomplexen und effizienten Prozesses, bei dem der Primärharn durch die Nierenkanälchen (Tubuli) geleitet und dort stark konzentriert sowie chemisch verändert wird. Der Körper sorgt dabei für einen regen Stoff- und Flüssigkeitsaustausch, um den Wasser- und Elektrolythaushalt optimal zu regulieren und Abfallstoffe effizient auszuscheiden.
Vom Primärharn zum Endharn
Der Übergang vom Primärharn zum Endharn erfolgt auf dem Weg durch die verschiedenen Abschnitte der Tubuli, die als Teil der funktionellen Einheit der Niere, dem Nephron, arbeiten. Hierbei laufen mehrere Vorgänge parallel ab:
Rückresorption von Wasser und Stoffen: Aus dem Primärharn werden nützliche Stoffe wie Glukose, Aminosäuren und Elektrolyte zurück in das Blut aufgenommen, um sie dem Körper erneut verfügbar zu machen.
Sekretion von Abfallstoffen: Gleichzeitig werden harnpflichtige Substanzen wie Harnstoff, Kreatinin und überschüssige Ionen aus dem Blut aktiv in die Tubuli abgegeben, um sie mit dem Endharn auszuscheiden.
Wasserrückresorption: Zwei Prozesse
Die Rückresorption des Wassers, ein wesentlicher Teil der Konzentration des Harns, erfolgt in zwei Hauptphasen:
Proximaler Tubulus:
In den Zellen des proximalen Tubulus befinden sich Natrium-Kalium-Pumpen, die Natrium aktiv in die umliegenden Blutgefäße transportieren.
Dadurch entsteht ein osmotisches Druckgefälle, das das Wasser passiv aus den Tubuli ins Blut zieht. Dieser Prozess ist äußerst effektiv und sorgt dafür, dass etwa 80% des Wassers aus dem Primärharn ins Blut zurückgeführt werden.
Henle-Schleife, distaler Tubulus und Sammelrohr:
Die Rückresorption von weiterem Wasser erfolgt unter der Kontrolle des antidiuretischen Hormons (ADH), das in der Hypophyse gebildet wird.
ADH reguliert die Durchlässigkeit der Zellwände im distalen Tubulus und im Sammelrohr, wodurch reines Wasser zurück in das Blut gelangt. Dieser Vorgang macht zusätzliche 18–19% des Primärharns aus.
Das Ergebnis: Endharn
Am Ende dieses Prozesses bleibt ein stark konzentrierter Harn übrig – der Endharn. Er besteht aus etwa 1,5 bis 2 Litern pro Tag und enthält die vom Körper ausgeschiedenen Abfallstoffe, Elektrolyte und überschüssige Flüssigkeit. Dieser Endharn wird in die Harnblase geleitet und schließlich ausgeschieden.
Feine Abstimmung der Harnbildung
Die Harnbildung umfasst nicht nur die Rückresorption von Wasser. Gleichzeitig werden weitere wichtige Stoffe wie Glukose, Kalium und Calcium aktiv aus dem Primärharn ins Blut rückresorbiert, während harnpflichtige Substanzen wie Harnstoff oder Medikamente aktiv aus dem Blut in die Tubuli abgegeben werden. Diese Prozesse sorgen dafür, dass der Endharn nur das enthält, was der Körper nicht mehr benötigt, und dass wertvolle Stoffe im Kreislauf verbleiben.
Fazit
Der Weg vom Primärharn zum Endharn ist ein hochpräziser Prozess, der den Wasser- und Elektrolythaushalt des Körpers reguliert und gleichzeitig schädliche Stoffe effizient entfernt. Die Nieren leisten dabei nicht nur eine Filterfunktion, sondern übernehmen auch eine aktive Rolle in der Rückresorption und Sekretion, wodurch der Endharn optimal an die Bedürfnisse des Körpers angepasst wird. Dieser fein abgestimmte Mechanismus sichert die Gesundheit und das Gleichgewicht im Körper.
Physiologie der Niere
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
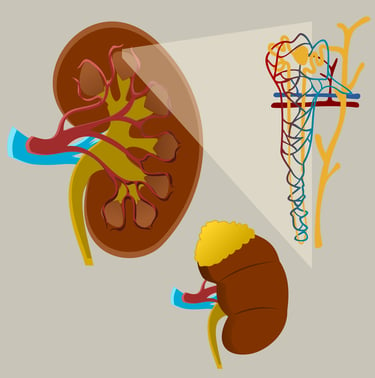
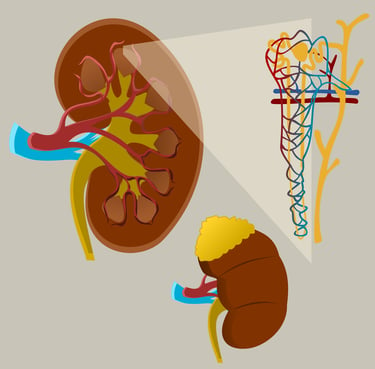
Die Nieren spielen eine zentrale Rolle bei der Regulation und Ausscheidung harnpflichtiger Substanzen, die im Stoffwechsel entstehen. Diese Substanzen müssen aus dem Körper entfernt werden, um eine Vergiftung oder Störungen des Gleichgewichts im Organismus zu verhindern.
Harnpflichtige Substanzen und ihre Bedeutung
Kreatinin: Kreatinin ist ein Abbauprodukt, das bei der Energieversorgung der Muskulatur entsteht. Obwohl es selbst nicht giftig ist, dient sein Anstieg im Blut als wichtiger Indikator für die Nierenfunktion. Ein erhöhter Kreatininwert deutet darauf hin, dass die Nieren das Kreatinin nicht ausreichend filtern können, was auf eine eingeschränkte Nierenfunktion hinweist.
Harnstoff: Harnstoff ist das Endprodukt des Eiweißstoffwechsels. Er wird in der Leber aus Ammoniak gebildet, das bei der Verstoffwechselung von Proteinen entsteht. Ein erhöhter Harnstoffspiegel im Blut kann auf eine gestörte Nierenfunktion oder auf einen erhöhten Eiweißabbau hindeuten.
Diese beiden Stoffe sind sensible Blutparameter, die Aufschluss über die sogenannte Vergiftungssituation des Körpers geben, wenn die Nieren ihre Filterfunktion nicht mehr ausreichend erfüllen.
Elektrolyte und ihre Regulation
Elektrolyte wie Kalium und Natrium sind essenziell für die Funktion von Nieren, Muskelzellen und anderen Geweben. Ihre Konzentration im Blut wird durch Prozesse der Rückresorption und Sekretion im Tubulussystem der Niere präzise gesteuert. Diese Regulation wird maßgeblich durch Hormone beeinflusst:
Aldosteron: Dieses Hormon wird in der Nebenniere gebildet und fördert im Tubulus die Rückresorption von Natriumionen sowie die Sekretion von Kalium- und Wasserstoffionen. Dadurch trägt Aldosteron zur Stabilisierung des Elektrolyt- und Flüssigkeitshaushalts bei.
Renin: Wenn der Natriumspiegel im Blut sinkt, setzt der juxtaglomeruläre Apparat der Niere das Hormon Renin frei. Renin löst eine Umwandlung von Bluteiweißkörpern aus, die zur Bildung von Angiotensin führen, welches wiederum die Freisetzung von Aldosteron anregt.
Zusätzlich wird auch die Kalziumkonzentration im Blut hormonell reguliert. Parathormon, das in der Nebenschilddrüse gebildet wird, erhöht die Ausscheidung von Phosphat im Urin und spielt eine Rolle bei der Regulierung des Kalziumhaushalts.
Phosphat: Phosphat wird aktiv im Glomerulus gefiltert und über den Endharn ausgeschieden. Parathormon fördert diese Ausscheidung, was die Balance zwischen Kalzium und Phosphat im Körper unterstützt.
Glukose und die Rolle der Nieren
Glukose wird im Glomerulus frei filtriert, was bedeutet, dass sie vollständig in den Primärharn gelangt. Unter normalen Umständen wird Glukose im Tubulussystem vollständig ins Blut zurückresorbiert. Liegt jedoch die Blutglukosekonzentration über 100 mg/dl, kann die Rückresorptionskapazität überschritten werden. In solchen Fällen gelangt Glukose in den Urin, ein Zustand, der als Glukosurie bezeichnet wird und häufig bei Diabetes mellitus auftritt.
Säure-Basen-Haushalt
Die Nieren spielen eine entscheidende Rolle bei der Regulation des pH-Werts im Blut (Normbereich: 7,36–7,44). Durch Rückresorptions- und Sekretionsvorgänge im Tubulussystem gleichen sie Schwankungen aus, die zu einer Übersäuerung (Azidose) oder einer Verschiebung in den basischen Bereich führen könnten.
Der Endharn, der schließlich ausgeschieden wird, hat typischerweise einen leicht sauren pH-Wert von etwa 5,5 und trägt so zur Stabilität des inneren Milieus bei.
Hormonproduktion der Niere
Die Niere ist nicht nur ein Filterorgan, sondern auch ein endokrines Organ, das verschiedene Hormone produziert:
Renin: Wird im juxtaglomerulären Apparat gebildet und reagiert auf eine verminderte Durchblutung oder einen Flüssigkeitsmangel. Es reguliert den Blutdruck und die Freisetzung von Aldosteron.
Erythropoetin: Dieses Hormon steuert die Bildung und Reifung der roten Blutkörperchen im Knochenmark. Rund 90% des Erythropoetins werden in der Niere gebildet.
Vitamin D (1,25-Cholecalciferol): Obwohl als Vitamin bezeichnet, handelt es sich eigentlich um ein Hormon. Es wird in der Niere in seine aktive Form umgewandelt und fördert die Kalziumaufnahme im Darm. Seine Wirkung wird teilweise durch Parathormon reguliert.
Fazit
Die Nieren übernehmen eine Vielzahl lebenswichtiger Aufgaben, von der Entfernung harnpflichtiger Substanzen bis zur Regulation von Elektrolyten, Glukose und dem Säure-Basen-Haushalt. Gleichzeitig produzieren sie wichtige Hormone, die den Blutdruck, die Bildung von roten Blutkörperchen und den Kalziumstoffwechsel steuern. Dieses komplexe Zusammenspiel macht die Nieren zu einem unverzichtbaren Organ für die Gesundheit und das Gleichgewicht des Körpers.
Harnpflichtige Substanzen: Wichtige Stoffe und ihre Rolle in der Nierenfunktion
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
HD = Hämodialyse - Die häufigste Form der Nierenersatztherapie
Die Hämodialyse ist die am weitesten verbreitete Methode zur Behandlung von Patienten mit Nierenversagen und eine der zentralen Säulen der Nierenersatztherapien. Sie übernimmt die lebenswichtige Funktion der Nieren, nämlich die Reinigung des Blutes von Abfallstoffen und überschüssigem Wasser sowie die Regulierung des Elektrolythaushalts.
Wie funktioniert die Hämodialyse?
Bei der Hämodialyse kommt eine spezielle Maschine zum Einsatz. Diese Maschine ermöglicht es, das Blut außerhalb des Körpers (extrakorporal) zu reinigen. Der Prozess beginnt damit, dass Blut über ein Schlauchsystem aus dem Körper des Patienten entnommen wird. Dieses Schlauchsystem ist direkt mit einem Dialysator, der sogenannten künstlichen Niere, verbunden.
Im Dialysator wird das Blut durch ein ausgeklügeltes Gegenstromprinzip gereinigt. Das bedeutet, dass das Blut auf der einen Seite einer semipermeablen Membran fließt, während auf der anderen Seite die Dialysierlösung in entgegengesetzter Richtung zirkuliert. Dieses Prinzip maximiert die Effizienz des Stoffaustausches, da stets ein Konzentrationsgefälle zwischen Blut und Dialysierlösung erhalten bleibt.
Der Reinigungsprozess
Der wichtigste Mechanismus der Reinigung ist die Diffusion. Hierbei wandern gelöste Stoffe wie Harnstoff, Kreatinin oder überschüssige Elektrolyte durch die Poren der semipermeablen Membran von der Seite des Blutes zur Dialysierlösung, da dort eine geringere Konzentration dieser Stoffe herrscht. Gleichzeitig kann die Dialysierlösung wichtige Stoffe enthalten, die dem Blut zugeführt werden, wie zum Beispiel Bikarbonat, um das Säure-Basen-Gleichgewicht des Körpers zu regulieren.
Die Membran des Dialysators spielt eine entscheidende Rolle, da ihre Porengröße genau festlegt, welche Stoffe durchgelassen werden und welche im Blut verbleiben. Große Moleküle wie Blutzellen, Fette und Proteine sind zu groß, um die Membran zu passieren, und bleiben daher im Blut.
Abschluss der Dialyse
Nachdem das Blut gereinigt wurde, wird es über das Schlauchsystem zurück in den Körper des Patienten geleitet. Dieser Prozess wird kontinuierlich wiederholt, bis eine ausreichende Menge Blut gereinigt wurde. Eine typische Hämodialysesitzung dauert in der Regel vier bis fünf Stunden und wird üblicherweise dreimal pro Woche durchgeführt. Während einer Behandlung werden pro Minute im Dialysator ca. 200-350 ml Blut mit Dialysierflüssigkeit in Kontakt gebracht und somit das gesamte Blutvolumen ca. 10x im Dialysator gereinigt.
Fazit
Die Hämodialyse ist ein hochkomplexes, aber effektives Verfahren, das Millionen von Menschen weltweit das Leben ermöglicht. Durch den Einsatz moderner Technologie und präziser Steuerung sorgt sie dafür, dass Patienten mit Nierenversagen trotz der Herausforderungen ihrer Erkrankung eine hohe Lebensqualität erreichen können.
HD -
Die Hämodialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
HF – Hämofiltration - Eine alternative Form der Blutreinigung
Die Hämofiltration (HF) ist eine weitere Methode der Nierenersatztherapie, die sich in ihrer Funktionsweise und ihrem Einsatzgebiet von der Hämodialyse unterscheidet. Sie wird häufig bei Patienten eingesetzt, die besonders empfindlich auf Kreislaufschwankungen reagieren, wie etwa ältere Menschen oder schwerkranke Patienten in der Intensivmedizin.
Funktionsweise der Hämofiltration
Wie bei der Hämodialyse wird das Blut des Patienten auch bei der Hämofiltration über ein Blutschlauchsystem aus dem Körper geleitet. Statt eines Dialysators kommt jedoch ein Hämofilter zum Einsatz. Das Blut wird durch diesen Filter gepumpt, der mit einer semipermeablen Membran ausgestattet ist. Diese Membran ermöglicht es, gelöste Stoffe und überschüssiges Wasser aus dem Blut zu entfernen, bevor das gereinigte Blut zurück in den Körper des Patienten transportiert wird.
Im Gegensatz zur Hämodialyse wird bei der Hämofiltration kein Dialysat (Dialysierlösung) verwendet. Die Reinigung des Blutes erfolgt durch einen Prozess namens Konvektion. Hierbei wird Flüssigkeit aus dem Blut durch die Membran herausgezogen, und die gelösten Abfallstoffe – wie harnpflichtige Substanzen – werden quasi „mitgenommen“. Dieser Mitnahmeeffekt sorgt dafür, dass schädliche Stoffe effizient entfernt werden.
Flüssigkeits- und Elektrolytausgleich
Da während der Hämofiltration große Mengen an Flüssigkeit entzogen werden, muss dieser Flüssigkeitsverlust ausgeglichen werden, um das Kreislaufsystem des Patienten zu stabilisieren. Dies geschieht durch die substitutionelle Zufuhr einer Elektrolytlösung, die dem Patienten gleichzeitig mit dem gereinigten Blut zurückgegeben wird. Diese Lösung ist sorgfältig zusammengesetzt, um das Elektrolytgleichgewicht des Körpers zu erhalten und mögliche Schwankungen zu vermeiden.
Vorteile der Hämofiltration
Die Hämofiltration bietet einige entscheidende Vorteile, insbesondere für Patienten, die empfindlich auf schnelle oder starke Veränderungen im Blutdruck reagieren. Da die Hämofiltration ohne Dialysat arbeitet und der Flüssigkeitsentzug über einen kontinuierlichen Prozess erfolgt, ist die Behandlung für den Kreislauf schonender. Dies macht sie besonders geeignet für ältere Menschen oder Patienten mit Kreislaufinstabilität, die bei anderen Verfahren wie der Hämodialyse Schwierigkeiten haben könnten.
Fazit
Die Hämofiltration ist eine effektive und schonende Alternative zur Hämodialyse, die insbesondere bei speziellen Patientengruppen eingesetzt wird. Sie ermöglicht eine sanfte, aber dennoch gründliche Reinigung des Blutes und trägt dazu bei, das Wohlbefinden und die Stabilität der Patienten zu fördern. Ihr Einsatz zeigt, wie vielfältig und anpassungsfähig die Möglichkeiten der Nierenersatztherapie heute sind, um auf die individuellen Bedürfnisse der Patienten einzugehen.
HF – Hämofiltration
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
HDF – Hämodiafiltration - Die Kombination von Hämodialyse und Hämofiltration
Die Hämodiafiltration (HDF) ist ein modernes Verfahren der Nierenersatztherapie, das die Vorteile von Hämodialyse und Hämofiltration kombiniert. Dieses Verfahren wird insbesondere dann eingesetzt, wenn eine besonders effektive Entfernung von Schadstoffen aus dem Blut notwendig ist, da es sowohl nieder- als auch mittelmolekulare Substanzen aus dem Körper entfernt. Damit bietet die HDF eine umfassendere Reinigungsleistung als die beiden einzelnen Verfahren.
Wie funktioniert die Hämodiafiltration?
Die Hämodiafiltration vereint zwei Mechanismen der Blutreinigung:
Diffusion: Wie bei der Hämodialyse ermöglicht die Diffusion den Austausch von gelösten Stoffen zwischen Blut und Dialysierlösung. Kleine Moleküle wie Harnstoff oder Kreatinin werden durch das Konzentrationsgefälle über die semipermeable Membran des Dialysators entfernt.
Konvektion: Wie bei der Hämofiltration wird Flüssigkeit (Ultrafiltrat) durch die Membran gezogen, wodurch auch größere Moleküle mitgenommen werden, die bei der Hämodialyse allein nicht entfernt werden könnten.
Diese Kombination macht die Hämodiafiltration besonders effektiv und vielseitig.
Der Ersatz des Ultrafiltrats
Ein zentraler Aspekt der HDF ist der kontrollierte Ersatz des entfernten Ultrafiltrats. Um den Flüssigkeitsverlust auszugleichen, wird dem Patienten eine physiologische Elektrolytlösung (Diluat) zugeführt. Diese Substitutionslösung ist so zusammengesetzt, dass sie den Elektrolyt- und Flüssigkeitshaushalt des Körpers stabil hält.
Die Elektrolytlösung kann auf zwei verschiedene Arten zugeführt werden:
Prädilution (vor dem Dialysator): Die Lösung wird dem Blut zugeführt, bevor es durch den Dialysator fließt. Dies verbessert die Konvektion, da das Blut weniger viskos ist und leichter durch die Membran fließt.
Postdilution (nach dem Dialysator): Die Lösung wird dem Blut erst nach der Passage durch den Dialysator zugesetzt. Diese Methode sorgt für eine effektivere Ultrafiltration und entfernt größere Mengen an Schadstoffen.
Unabhängig von der Methode wird die zugeführte Lösung im Dialysator wieder entfernt, wodurch ein kontinuierlicher Kreislauf entsteht.
Effektivität der HDF
Ein wesentlicher Vorteil der Hämodiafiltration ist der höhere transmembrane Fluss, der durch den gezielten Ersatz des Ultrafiltrats ermöglicht wird. Dies führt zu einer intensiveren Reinigung und erlaubt die Entfernung von Schadstoffen, die bei der Hämodialyse oder Hämofiltration allein nicht in gleichem Maße eliminiert werden können. Insbesondere mittelmolekulare Substanzen, die mit langfristigen Komplikationen bei Dialysepatienten in Verbindung gebracht werden, lassen sich mit der HDF effektiv entfernen.
Vorteile der Hämodiafiltration
Die Hämodiafiltration wird häufig bei Patienten eingesetzt, die von einer gründlicheren Reinigung profitieren, wie zum Beispiel bei chronischen Dialysepatienten mit längerfristigen Stoffwechselbelastungen. Zu den Vorteilen zählen:
Effektivere Entfernung von nieder- und mittelmolekularen Substanzen.
Verbesserte Lebensqualität durch reduzierte Symptome von Dialysekomplikationen.
Bessere Kreislaufstabilität im Vergleich zur Hämofiltration allein.
Fazit
Die Hämodiafiltration ist ein leistungsstarkes Verfahren der Nierenersatztherapie, das die Stärken von Hämodialyse und Hämofiltration vereint. Durch ihre Fähigkeit, eine breite Palette von Schadstoffen aus dem Blut zu entfernen und den Flüssigkeits- und Elektrolythaushalt zu stabilisieren, bietet die HDF eine besonders effektive und schonende Behandlungsmöglichkeit für Patienten mit chronischem oder akutem Nierenversagen.
HDF – Hämodiafiltration
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
PD – Peritonealdialyse - Blutreinigung durch das Bauchfell
Die Peritonealdialyse (PD) ist eine Methode der Nierenersatztherapie, bei der das Bauchfell (lat. Peritoneum) als natürliche, semipermeable Membran genutzt wird. Im Gegensatz zu Verfahren wie der Hämodialyse oder Hämodiafiltration, bei denen das Blut außerhalb des Körpers durch eine Maschine gereinigt wird, findet die Blutreinigung bei der Peritonealdialyse direkt im Körperinneren statt – genauer gesagt, in der Bauchhöhle.
Wie funktioniert die Peritonealdialyse?
Das Bauchfell, eine dünne Gewebeschicht, die die Bauchhöhle auskleidet und die inneren Organe umgibt, hat besondere Eigenschaften, die es zu einer natürlichen Filtermembran machen. Es ist durchzogen von Blutgefäßen und erlaubt den Austausch von gelösten Stoffen sowie Wasser zwischen dem Blut und der in die Bauchhöhle eingeführten Dialyselösung.
Der Ablauf der Peritonealdialyse lässt sich in drei Hauptschritte unterteilen:
Einfüllen der Dialyselösung: Über einen Katheter, der zuvor chirurgisch in die Bauchhöhle eingesetzt wurde, wird eine sterile Dialyselösung in die Bauchhöhle eingefüllt. Diese Lösung enthält Elektrolyte, Zucker (meist Glukose) und weitere Substanzen, die den Stoffaustausch fördern.
Verweildauer (Dwell-Zeit): Während die Dialyselösung in der Bauchhöhle verbleibt, diffundieren Abfallstoffe und überschüssige Elektrolyte aus dem Blut, das die Bauchfellkapillaren durchströmt, in die Lösung. Gleichzeitig wird überschüssiges Wasser durch Osmose aus dem Blut in die Lösung gezogen. Dieser Prozess dauert mehrere Stunden.
Ablassen der verbrauchten Lösung: Nach der Verweildauer wird die mit Schadstoffen und überschüssiger Flüssigkeit beladene Dialyselösung durch den Katheter abgelassen. Anschließend wird frische Dialyselösung eingefüllt, und der Zyklus beginnt von vorn.
Arten der Peritonealdialyse
Es gibt zwei Hauptformen der Peritonealdialyse:
Kontinuierliche ambulante Peritonealdialyse (CAPD): Hierbei erfolgt der Austausch der Dialyselösung manuell, in der Regel viermal täglich. Der Patient kann diesen Prozess selbstständig durchführen, was ihm eine größere Flexibilität und Unabhängigkeit ermöglicht.
Automatisierte Peritonealdialyse (APD): Bei dieser Variante übernimmt ein Gerät (ein sogenannter Cycler) den Austausch der Dialyselösung. Die Behandlung erfolgt meist während der Nacht, während der Patient schläft.
Vorteile der Peritonealdialyse
Die Peritonealdialyse bietet einige besondere Vorteile:
Schonend für den Kreislauf: Da die Reinigung des Blutes kontinuierlich und sanft erfolgt, werden Kreislaufschwankungen, wie sie bei der Hämodialyse auftreten können, vermieden.
Flexibilität und Unabhängigkeit: Patienten können die Dialyse zu Hause oder unterwegs durchführen, ohne auf eine spezielle Einrichtung angewiesen zu sein.
Erhalt der Restnierenfunktion: Die Peritonealdialyse trägt oft dazu bei, die verbleibende Funktion der Nieren länger zu erhalten.
Einschränkungen und Herausforderungen
Wie bei jedem Verfahren gibt es auch bei der Peritonealdialyse Herausforderungen. Eine der häufigsten Komplikationen ist die Peritonitis, eine Entzündung des Bauchfells, die durch Infektionen verursacht werden kann. Zudem ist die Methode bei bestimmten anatomischen oder gesundheitlichen Gegebenheiten, wie etwa nach große Bauch-Operationen, nicht geeignet.
Fazit
Die Peritonealdialyse ist eine effektive und schonende Form der Nierenersatztherapie, die das Bauchfell als natürliche Filtermembran nutzt. Sie stellt eine flexible Alternative zur Hämodialyse dar und ermöglicht vielen Patienten ein unabhängiges Leben, während gleichzeitig eine umfassende Blutreinigung gewährleistet wird.
PD – Peritonealdialyse
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Eine Dialysemaschine ist ein komplexes medizinisches Gerät, das die Funktion der Nieren ersetzt, indem es das Blut reinigt, überschüssige Flüssigkeit entfernt und das Gleichgewicht von Elektrolyten und Säuren im Körper wiederherstellt. Hier ist eine einfache Erklärung der Funktionsweise:
1. Blutentnahme und Zuführung zur Maschine
Das Blut des Patienten wird über einen Gefäßzugang aus dem Körper entnommen. Dieser Zugang kann ein arteriovenöser Shunt oder Dialysekatheter sein. Das Blut wird über ein Schlauchsystem in den Dialysator geleitet, wo es gereinigt wird.
2. Funktion des Dialysators (künstliche Niere)
Der Dialysator ist das zentrale Element der Dialysebehandlung. Er besteht aus einer Vielzahl von Hohlfasern oder Membranen, die als Filter fungieren. Der Reinigungsprozess im Dialysator basiert auf zwei physikalischen Prinzipien:
Diffusion: Gelöste Stoffe wie Harnstoff, Kreatinin und überschüssige Elektrolyte wandern durch die semipermeable Membran von der Blutseite zur Dialysatseite, weil dort ein Konzentrationsgefälle besteht. So werden Abfallstoffe aus dem Blut entfernt.
Ultrafiltration: Durch einen kontrollierten Druckunterschied wird überschüssiges Wasser aus dem Blut durch die Membran in das Dialysat gedrückt. Dies hilft, Flüssigkeitsansammlungen im Körper zu reduzieren.
Die Membran des Dialysators lässt kleine Moleküle wie Abfallstoffe und Wasser passieren, hält jedoch größere Moleküle wie Proteine, Fette und Blutzellen zurück.
3. Dialysat und Reinigung des Blutes
Das Dialysat ist eine spezielle Flüssigkeit, die für den Reinigungsprozess notwendig ist. Es wird kontinuierlich durch die Maschine geleitet und auf die jeweils benötigte Zusammensetzung eingestellt. Es enthält:
Elektrolyte (z. B. Natrium, Kalium) in Konzentrationen, die dem Blut entsprechen oder angepasst werden können.
Bikarbonat oder andere Pufferstoffe, um das Säure-Basen-Gleichgewicht im Blut zu regulieren.
Das Dialysat nimmt die Abfallstoffe und überschüssige Flüssigkeit aus dem Blut auf und wird danach entsorgt.
4. Überwachung und Steuerung durch die Maschine
Die Dialysemaschine überwacht und reguliert den gesamten Prozess, um eine sichere und effektive Behandlung zu gewährleisten:
Blutfluss: Die Maschine kontrolliert die Geschwindigkeit des Blutflusses (typisch 200–400 ml/min).
Drucküberwachung: Die arterielle und venöse Druckmessung an der Dialysemaschine dient der Überwachung des Blutflusses im Kreislauf während der Dialyse
Arterieller Druck: Misst den Druck vor der Blutpumpe. Ein zu niedriger Druck kann auf eine Verstopfung im Zugang (zz.Bsp.: Shunt) hinweisen
Venöser Druck: Misst den Druck nach dem Dialysator, bevor das Blut zurück in den Körper fließt. Ein erhöter Druck kann auf einen Widerstand in der Rückleitung hindeuten.
TMP (engl.: Transmembrane Pressure) steht in Bezug auf die Dialyse für Transmembrandruck. Einfach erklärt: TMP beschreibt den Druckunterschied zwischen Blutseite und der Dialysatseite der Dialysemembran. Er zeigt an, wie stark das Filtrat (also überschüssiges Wasser und gelöste Stoffe) durch die Membran gepresst wird
Ultrafiltration: Die Menge an Flüssigkeit, die entzogen wird, wird genau gesteuert.
Dialysatkontrolle: Die Temperatur, Zusammensetzung und der Fluss des Dialysats werden überwacht und angepasst.
5. Rückführung des gereinigten Blutes
Das gereinigte Blut wird aus dem Dialysator durch ein Schlauchsystem zurück in den Körper des Patienten geleitet. Dabei durchläuft es einen Sicherheitsmechanismus, der sicherstellt, dass keine Luftblasen oder Verunreinigungen ins Blut gelangen.
Zusatzfunktionen Maschinen
Dialysemaschinen bieten zusätzliche Funktionen:
Heparinzufuhr: Eine präzise Dosierung von Heparin (Blutverdünnungsmittel), um Blutgerinnung im Schlauchsystem zu verhindern.
Online-Hämodiafiltration: Kombination von Hämodialyse und Hämofiltration zur intensiveren Reinigung.
Kontinuierliche Überwachung: Sensoren überwachen die Blutkonzentrationen von Sauerstoff, Elektrolyten und Temperatur.
Fazit
Eine Dialysemaschine ist ein technologisches Meisterwerk, das den Körper entlastet, indem es schädliche Substanzen entfernt, den Wasserhaushalt reguliert und das Säure-Basen-Gleichgewicht wiederherstellt. Sie ist lebenswichtig für Menschen mit schwerer Niereninsuffizienz und ermöglicht eine regelmäßige Reinigung des Blutes außerhalb des Körpers.
Wie funktioniert eine Dialysemaschine?
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die Ernährung von Dialysepatienten spielt eine entscheidende Rolle bei der Behandlung und der Vermeidung von Komplikationen. Dialysepatienten müssen besondere Ernährungsrichtlinien befolgen, um den Körper trotz der eingeschränkten Nierenfunktion im Gleichgewicht zu halten. Hier sind die wichtigsten Punkte und Tipps zur Ernährung, basierend auf verschiedenen Nahrungsbestandteilen und Lebensmitteln.
Grundprinzip: Die Menge macht’s
Dialysepatienten dürfen grundsätzlich alles essen, aber die Menge und die Auswahl der Lebensmittel sind entscheidend. Einige Nährstoffe wie Kalium, Phosphat oder Natrium müssen streng kontrolliert werden, da sie in zu hohen Konzentrationen schwerwiegende gesundheitliche Probleme verursachen können.
Nährstoffspezifische Empfehlungen
1. Kalium
Ein zu hoher Kaliumspiegel im Blut kann bei Dialysepatienten zu Herzrhythmusstörungen bis hin zu einem Herzstillstand führen. Symptome wie Kribbeln in Armen und Beinen, Muskelschwäche und Muskelschmerzen können auf einen erhöhten Kaliumspiegel hinweisen.
Empfehlung: Kaliumaufnahme über die Nahrung möglichst gering halten. In akuten Fällen kann ein Kaliumbinder verschrieben werden.
Tipp: Vor dem Kochen von kaliumreichen Lebensmitteln wie Kartoffeln oder Gemüse diese klein schneiden und in viel Wasser garen. Das Kochwasser sollte anschließend weggeschüttet werden.
2. Phosphat und Kalzium
Ein unausgewogenes Verhältnis von Phosphat und Kalzium kann langfristig zu Knochenveränderungen und Gefäßverhärtungen führen. Diese Prozesse sind schleichend und zeigen oft erst nach Jahren Symptome wie Juckreiz, Knochenschmerzen und sogar spontane Frakturen.
Empfehlung: Phosphat- und Kalziumzufuhr über die Nahrung reduzieren. Besonders Konservierungsstoffe enthalten viel Phosphat.
Unterstützung: Die Einnahme eines Phosphatbinders vor den Mahlzeiten kann helfen, Phosphat im Darm zu binden und auszuscheiden.
3. Natrium (Salz)
Eine hohe Natriumaufnahme führt zu Wassereinlagerungen und verstärktem Durst, was bei Dialysepatienten problematisch ist, da die Flüssigkeitszufuhr begrenzt werden muss.
Empfehlung: Salz in der Ernährung reduzieren und stattdessen mit Kräutern würzen.
Symptom: Anhaltender Durst ist ein Anzeichen für eine überhöhte Natriumaufnahme.
4. Eiweiße
Eine eiweißreiche Ernährung ist wichtig, da Dialysepatienten durch die Behandlung vermehrt Eiweiß verlieren. Allerdings enthalten viele eiweißreiche Lebensmittel auch hohe Mengen an Phosphat.
Empfehlung: Lebensmittel mit hohem Eiweiß- und niedrigem Phosphatgehalt wählen, z. B. mageres Fleisch (Rind, Schwein, Kalb, Geflügel) oder Weichkäse.
5. Flüssigkeitsaufnahme
Dialysepatienten müssen ihre tägliche Trinkmenge kontrollieren. Sowohl Getränke als auch Lebensmittel mit hohem Flüssigkeitsanteil (z. B. Suppen, Joghurt) zählen zur Gesamtmenge.
Formel zur Berechnung der Trinkmenge:
500 ml + Restharnmenge (Restdiurese) = maximale Flüssigkeitsaufnahme pro Tag.Symptome einer Überwässerung: Ödeme, Bluthochdruck, Herz-Kreislauf-Probleme.
Tipps gegen Durst:
Wasser mit Zitrone oder zuckerfreier Tee.
Saure Bonbons, zuckerfreier Kaugummi oder kleine Eiswürfel (z. B. aus Tee oder Wasser).
Lippenpflege, um ein Austrocknen der Lippen zu verhindern.
Langsam trinken, in kleinen Schlucken und mit kleinen Trinkgefäßen.
Eine angenehme Luftfeuchtigkeit im Raum schaffen.
Lebensmittelgruppen im Überblick
Getreideprodukte
Empfehlung: Vollkornprodukte meiden, da sie viel Kalium enthalten. Stattdessen zu raffinierten Getreideprodukten greifen.
Kartoffeln und Gemüse
Kartoffeln und viele Gemüsesorten enthalten viel Kalium.
Tipp: Vor dem Kochen klein schneiden und in viel Wasser garen. Das Kochwasser unbedingt weggießen.
Obst
Obst hat oft einen hohen Kaliumgehalt.
Empfehlung: Eine Handvoll Obst pro Tag ist ausreichend. Trockenobst vermeiden, da es besonders viel Kalium enthält.
Tipp: Verdünnte Obstsäfte als Alternative.
Milch und Milchprodukte
Geeignet: Weichkäse, Doppelrahmfrischkäse, Butterkäse – diese haben einen geringen Phosphatgehalt.
Tipp: Sahne immer mit Wasser verdünnen, um den Phosphatgehalt zu reduzieren.
Fisch und Fleisch
Empfehlung: 1–2 Mal pro Woche fettarme und salzarme Sorten wählen, z. B. mageres Fleisch (Huhn, Pute, Kalb) oder fettarme Fische wie Kabeljau, Scholle, Flunder.
Fette und Öle
Empfehlung: Tierische Fette meiden und stattdessen pflanzliche Fette wie Sonnenblumenöl, Olivenöl oder Diätmargarine verwenden.
Zucker und Salz
Empfehlung: Zucker und Salz möglichst sparsam verwenden. Zum Würzen lieber auf frische Kräuter zurückgreifen.
Wichtiger Hinweis: Bewegung
Neben der Ernährung ist für Dialysepatienten ausreichend Bewegung wichtig, um den Stoffwechsel zu unterstützen und die allgemeine Gesundheit zu fördern.
Fazit
Eine ausgewogene Ernährung ist ein entscheidender Faktor für die Lebensqualität von Dialysepatienten. Die richtige Auswahl und Zubereitung von Lebensmitteln kann helfen, gesundheitliche Risiken zu minimieren und das Wohlbefinden zu steigern. Dabei ist es wichtig, die individuellen Empfehlungen mit dem behandelnden Arzt oder Ernährungsberater abzusprechen.
Tipps zur Ernährung für Dialysepatienten
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Dialyseshunt – Die Lebensader von Dialysepatienten
Ein Dialyseshunt ist ein spezieller Gefäßzugang, der bei Hämodialysepatienten notwendig ist, um das Blut effizient von Giftstoffen und überschüssigem Wasser zu reinigen. Er stellt die Verbindung zwischen dem Blutkreislauf des Patienten und der Dialysemaschine her und ist damit ein essenzieller Bestandteil der Behandlung.
Warum ist ein Shunt notwendig?
Die Nieren sind normalerweise dafür zuständig, Giftstoffe und überschüssige Flüssigkeit aus dem Blut zu entfernen. Bei eingeschränkter Nierenfunktion übernimmt die Hämodialyse diese Aufgabe mithilfe einer Blutwäsche. Um eine optimale Dialysebehandlung zu gewährleisten, wird ein spezieller Gefäßzugang benötigt – der Dialyseshunt.
Anlage des Shunts
Zeitpunkt und Ort der Anlage:
Der Shunt wird idealerweise 4–6 Wochen vor der ersten Dialyse angelegt, um ausreichend Zeit für die Heilung und Anpassung zu gewährleisten.
Am häufigsten wird der Shunt am Unterarm angelegt, kann aber je nach Gefäßbeschaffenheit auch an anderen Stellen wie Oberarm, Ellenbeuge, Oberschenkel oder im Brustbereich (Dekolleté) eingerichtet werden.
Technische Umsetzung:
Bei guten Gefäßverhältnissen wird eine direkte Verbindung zwischen einer Arterie und einer Vene hergestellt.
Sind die Gefäße ungeeignet, wird ein Kunststoffschlauch verwendet, um die Verbindung herzustellen.
Funktion und Anpassung der Gefäße
In den Arterien fließt Blut mit einem höheren Druck als in den Venen. Durch die Verbindung mit der Arterie wird die Vene einem ungewohnten Druck ausgesetzt.
Um diesen Druck langfristig standzuhalten, passt sich die Vene an: Sie vergrößert ihr Volumen und ihre Wanddicke.
Dieser Anpassungsprozess dauert etwa 4–6 Wochen und kann durch ein gezieltes Shunttraining gefördert werden.
Punktionstechniken für den Shunt
Die Wahl der Punktionstechnik hat direkten Einfluss auf die Lebensdauer des Shunts und die Lebensqualität des Patienten. Es gibt drei Haupttechniken:
Strickleiterpunktion:
Die gesamte Länge des Shunts wird gleichmäßig genutzt.
Vorteile: Geringere Ausweitung des Shunts, weniger Aneurysmen und Stenosen, längere Lebensdauer des Shunts, ästhetisch ansprechender.
Nachteile: Schmerzhafter und höhere Fehlpunktionrate.
Arealpunktion:
Die Nadel wird immer im selben Areal gesetzt.
Vorteile: Weniger schmerzhaft, geringere Fehlpunktionrate.
Nachteile: Höhere Wahrscheinlichkeit für Stenosen und Aneurysmen, ästhetisch weniger ansprechend, kürzere Lebensdauer des Shunts.
Knopflochpunktion:
Die Nadel wird dauerhaft an einer einzigen Einstichstelle gesetzt.
Vorteile: Schmerzarm, geringe Fehlpunktionrate, geeignet für Selbstpunktion.
Nachteile: Erhöhtes Infektionsrisiko durch Eindringen von Schorf in die Blutbahn, längere Abdrückzeit, ungeeignet für Kunststoffshunts.
Praktische Herausforderungen bei der Punktion
In der Praxis wird oft die Arealpunktion bevorzugt, da sie von Patienten als schmerzärmer empfunden wird und Pflegekräfte bei Stress oder Zeitdruck diese Technik als einfacher empfinden. Jedoch sollte stets daran erinnert werden, dass eine korrekte Punktionstechnik entscheidend für die Lebensdauer des Shunts ist. Patienten und Pflegepersonal müssen regelmäßig über die richtige Handhabung und Pflege geschult werden.
Abdrücken des Shunts
Nach der Dialyse müssen die Nadeln aus dem Shunt entfernt und die Einstichstellen abgedrückt werden, um Nachblutungen zu verhindern.
Anleitung und Materialien:
Das Abdrücken wird anfänglich von der Fachkraft durchgeführt und der Patient wird später angeleitet, es selbstständig zu übernehmen.
Es werden sterile Tupfer oder sterile Handschuhe verwendet.
Druckkontrolle:
Der Druck sollte so ausgeübt werden, dass die Blutung stoppt, aber das charakteristische „Rauschen“ des Shunts unter den Fingerspitzen weiterhin spürbar bleibt.
Falls der Tupfer blutig wird, muss der Druck erhöht werden.
Abdrückzeit:
Eigene Gefäße: 15–25 Minuten.
Kunststoffshunt: 35–45 Minuten.
Nach dem Abdrücken werden die Punktionsstellen mit einem Pflaster versorgt, das idealerweise bis zum nächsten Morgen verbleibt.
Häufige Probleme beim Abdrücken
In der Praxis halten viele Patienten die optimale Abdrückzeit nicht ein, was zu Nachblutungen führen kann. Sollte es nach dem Abdrücken zu einer erneuten Blutung kommen:
Soforthilfe:
Erlernte Technik erneut anwenden, mit sterilem Tupfer oder zur Not mit den Fingerspitzen.
Schwerwiegendere Fälle:
Bei anhaltender Blutung das Dialysezentrum kontaktieren oder die Notrufnummer 112 wählen.
Fazit
Ein Dialyseshunt ist die Lebensader von Dialysepatienten. Seine korrekte Anlage, Nutzung und Pflege sind entscheidend für eine erfolgreiche Behandlung und die Lebensqualität des Patienten. Die Wahl der Punktionstechnik, das richtige Abdrücken und die Sensibilisierung von Patienten und Pflegekräften spielen eine wesentliche Rolle, um Komplikationen zu vermeiden und die Lebensdauer des Shunts zu maximieren.
Gefäßzugänge: Dialyseshunt
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Getunnelter Vorhofkatheter (Demerskatheter) – Ein essenzieller Dialysezugang
Ein getunnelter Vorhofkatheter, auch Demerskatheter genannt, ist ein spezieller Zugang für Dialysepatienten, der von dem Oberarzt Demers in Darmstadt entwickelt wurde. Ursprünglich ein einlumiger Katheter, wird er heute in ein- und zweilumigen Varianten von verschiedenen Herstellern angeboten. Er bietet eine wichtige Alternative zu anderen Dialysezugängen wie Shunts, besonders bei Patienten mit eingeschränkten Gefäßstrukturen oder dringendem Dialysebedarf.
Aufbau und Funktionsweise des Demerskatheters
Material und Design:
Der Demerskatheter besteht aus speziellem Material, das für eine langfristige Nutzung geeignet ist.
Eine Muffe aus Dacron-Gewebe, die kurz hinter der Eintrittsstelle liegt, ist ein wesentliches Merkmal. Diese Muffe wächst ins Bindegewebe ein und stabilisiert den Katheter, was das Infektionsrisiko reduziert.
Anlage:
Die Implantation des Katheters erfolgt in einer kleinen Operation, häufig unter örtlicher Betäubung.
Bevorzugt wird die rechte Vena jugularis interna als Zugang, da sie einen hohen Blutfluss bietet und das Risiko für Stenosen im Vergleich zur Vena subclavia geringer ist.
Einsatzmöglichkeiten
Der Demerskatheter wird in verschiedenen Situationen eingesetzt:
Patienten mit schlechten Gefäßstrukturen: Er ermöglicht eine effektive Dialysebehandlung, wenn andere Zugänge wie ein Shunt nicht möglich sind.
Übergangslösung: Während der Heilungsphase eines neu angelegten Shunts kann der Katheter als temporärer Zugang dienen.
Ein großer Vorteil des Demerskatheters ist seine sofortige Einsatzbereitschaft, wodurch er insbesondere in Notfallsituationen unverzichtbar ist. Außerdem kann er bei Komplikationen schnell und kostengünstig ersetzt werden.
Hauptkomplikationen
Trotz seiner Vorteile birgt der Demerskatheter spezifische Risiken, die regelmäßig überwacht und behandelt werden müssen:
1. Thromboserisiko
Ursachen:
Thromben können sich an den Perforationslöchern des Katheters bilden und zu einem Verschluss führen.
Ein Abknicken des Katheters kann den Blutfluss zusätzlich beeinträchtigen.
Vorbeugung:
Nach jeder Dialyse wird der Katheter mit Heparin geblockt, um die Bildung von Thromben zu verhindern. Die erforderliche Heparindosis hängt vom Lumen des Katheters ab.
2. Infektionsrisiko
Mögliche Infektionswege:
Entlang des Katheters: Keime können von der Eintrittsstelle entlang des Katheters eindringen.
Intraluminale Infektion: Keime gelangen direkt ins Lumen des Katheters, oft ohne sichtbare Infektionszeichen an der Eintrittsstelle.
Folgen:
Eine intraluminale Infektion kann schwerwiegende Komplikationen wie Endokarditis, septischen Schock, Osteomyelitis oder epidurale Abszesse verursachen. In diesen Fällen ist häufig die Entfernung des Katheters notwendig, begleitet von einer langwierigen Antibiotikatherapie.
KAST-Klassifizierung für Infektionen
Die Beurteilung der Eintrittsstelle erfolgt anhand der KAST-Klassifikation. Diese hilft, den Schweregrad der Infektion einzuschätzen und die weitere Behandlung zu planen:
KAST 0: Unauffällige Eintrittsstelle, Reinigung mit NaCl 0,9%, keine Desinfektion notwendig, Transparentverband.
KAST 1: Leichte Rötung, trockene Kruste, kein Exsudat, Desinfektion und Folienverband mit oder ohne Wirkstoff.
KAST 2: Leichte Rötung, wenig klares Exsudat, keine Schmerzen, Wundabstrich nach Arztanordnung.
KAST 3: Starke Rötung, trübes Exsudat, leichte Schmerzen, Abstrich und Blutkulturen erforderlich.
KAST 4: Deutliche Infektionszeichen, purulentes Exsudat, starker Druckschmerz, eventuell Katheterentfernung und Tunnelsonographie.
Transparentverbände sind besonders geeignet, da sie die Eintrittsstelle sichtbar machen, wasser- und bakterienundurchlässig sind und nur einmal wöchentlich gewechselt werden müssen.
Lebensqualität und Einschränkungen
Kosmetische Aspekte: Der Demerskatheter ist äußerlich sichtbar, was von vielen Patienten als Einschränkung der Lebensqualität (meist im Sommer) empfunden wird.
Körperpflege:
Patienten dürfen nicht baden.
Duschen ist nur erlaubt, wenn der Katheter reizlos ist und die Eintrittsstelle gut geschützt ist.
Alternativ ist die Körperpflege auf Waschen beschränkt.
Lebensdauer:
Der Katheter hat eine begrenzte Lebensdauer, da niedrige Blutflussraten längere Dialysezeiten erfordern und das Risiko von Komplikationen erhöht wird.
Fazit
Der Demerskatheter bietet eine essenzielle Alternative für Patienten, die keine anderen dauerhaften Dialysezugänge nutzen können. Seine sofortige Einsatzbereitschaft und einfache Austauschbarkeit machen ihn besonders in Notfallsituationen wertvoll. Allerdings erfordert er eine sorgfältige Pflege und Überwachung, um Komplikationen wie Thrombosen und Infektionen zu minimieren. Eine gute Schulung von Pflegepersonal und Patienten sowie regelmäßige Kontrollen sind entscheidend, um die Funktionalität und Sicherheit des Katheters zu gewährleisten.
Gefäßzugänge: Getunnelter Vorhofkatheter (Demerskatheter)
🛈 Hinweis: Dieser Beitrag dient nur der Information und ersetzt keine ärztliche Beratung.
Die wichtigsten Medikamente für Dialysepatienten
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Wasseraufbereitung und Umkehrosmoseanlage: Ein detaillierter Einblick
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Überprüfe Dein Wissen
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
QUIZ
Modul 1
Modul 2
Modul 3
Modul 5
Modul 10
Modul 13
Modul 1:
Grundlagen der Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 2:
Geschichte der Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 3:
Anatomie der Niere
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 4:
Mikroskopischer Aufbau der Niere
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 5:
Physiologie der Niere
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 6:
Harnpflichtige Substanzen, Elektrolyte und Hormone
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 7:
Dialysearten: HD, HF, HDF, PD
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 8:
Dialysemaschine: Aufbau und Überwachung
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 9:
Wasseraufbereitung und Umkehrosmose
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 10:
Gefäßzugänge I: Dialyseshunt
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 11:
Gefäßzugänge II: Demerskatheter & Vergleich
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 12:
Medikamente & Ernährung bei Dialyse
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Modul 13:
Dialyse Funfacts
🛈 Hinweis: Dieser Beitrag dient nur der
Information und ersetzt keine ärztliche Beratung.
Marcel
Schauen Sie auf meinen YouTube Kanälen vorbei
marcel@marcels-art.com
© 2025. All rights reserved.
weitere Webseiten von Marcel:



